Latihan 2
Contoh 1.3
(a) Di bawah suhu transisi -141°C, zat tertentu menjadi superkonduktor; artinya, ia dapat menghantarkan listrik tanpa hambatan. Berapa suhunya dalam derajat Fahrenheit? (b) Helium memiliki titik didih terendah dari semua unsur di -452°F. Ubah suhu ini menjadi derajat Celcius. (c) Merkuri, satu-satunya logam yang ada sebagai cairan pada suhu kamar, meleleh pada suhu -38,9°C. Ubah titik lelehnya menjadi kelvin.
Solusi Ketiga bagian ini mengharuskan kami melakukan konversi suhu, jadi kami membutuhkan Persamaan (1.2), (1.3), dan (1.4). Perlu diingat bahwa suhu terendah pada Skala Kelvin adalah nol (0 K); oleh karena itu, tidak pernah bisa negatif.
(a) Konversi ini dilakukan dengan menulis
(b) Ini dia
(d) Titik leleh merkuri dalam kelvin ditentukan oleh
Latihan Ubah (a) 327.5°C (titik leleh timah) menjadi derajat Fahrenheit; (b) 172,9°F (titik didih etanol) menjadi derajat Celcius; dan (c) 77 K, titik didih nitrogen cair, ke derajat Celcius.
(a)
=589.5℉ + 32℉
= 621.5℉
(b)
Tuliskan jumlah proton, neutron, dan elektron pada masing-masing spesies berikut:
(a) 2011Na, (b)2211Na, (c)17O, dan (d) karbon-14.
Strategi Ingatlah bahwa superskrip menunjukkan nomor massa (A) dan subskrip menunjukkan nomor atom (Z). Nomor massa selalu lebih besar dari nomor atom. (Satu-satunya pengecualian adalah 11H, dimana nomor massa sama dengan nomor atom.) dalam kasus di mana tidak ada subskrip yang ditampilkan, seperti pada bagian (c) dan (d), nomor atom dapat disimpulkan dari simbol elemen atau nama. Untuk menentukan jumlah elektron, Ingatlah bahwa karena atom netral secara elektrik, jumlah elektronnya sama dengan jumlah proton.
Solusi
(a) Nomor atomnya 11, jadi ada 11 proton. Nomor massanya 20, jadi
jumlah neutronnya adalah 20 - 11 = 9. Jumlah elektronnya sama dengan
jumlah proton; yaitu, 11.
(b) Nomor atomnya sama dengan yang ada di (a), atau 11. Nomor massanya adalah 22, jadi jumlah neutronnya adalah 22 - 11 = 11. Jumlah elektronnya adalah 11. Perhatikan itu spesies dalam (a) dan (b) adalah isotop natrium yang secara kimiawi mirip.
(c) Nomor atom O (oksigen) adalah 8, jadi ada 8 proton. Nomor massanya adalah 17, jadi ada 17 - 8 = 9 neutron. Ada 8 elektron.
(d) Karbon-14 juga dapat direpresentasikan sebagai 14C . Nomor atom karbon adalah 6, jadi
ada 14 - 6 = 8 neutron. Jumlah elektronnya adalah 6.
Latihan Berapa banyak proton, neutron, dan elektron di berikut ini
isotop tembaga:
63Cu?
nomor atom pada Cu adalah 29
nomor atom = jumlah proton = jumlah elektron = 29
jumlah neutron = nomor massa - nomor atom
jumah neutron = 63 - 29 = 34
Contoh 3.5
Hitung massa molekul (dalam amu) dari senyawa berikut: (a) sulfur dioksida (SO2), gas yang bertanggung jawab atas hujan asam, dan (b) kafein (C8H10N4O2), stimulant yang ada dalam minuman teh, kopi, dan cola.
Strategi Bagaimana massa atom dari unsur-unsur yang berbeda bergabung menjadi molekul massa suatu senyawa?
Solusi Untuk menghitung massa molekul, kita perlu menjumlahkan semua massa atom pada molekul. Untuk setiap unsur, kita mengalikan massa atom unsur dengan nomor atom dari unsur molekulnya. Kami menemukan massa atom di tabel periodic (sampul depan bagian dalam).
(a) Ada dua atom O dan satu atom S dalam SO2, jadi
massa molekuler SO2 = 32.07 amu + 2 (16.00 amu)
= 64.07 amu
(a) Ada delapan atom C, sepuluh atom H, empat atom N, dan dua atom O dalam kafein, jadi massa molekul C8H10N4O2 adalah
8 (12.01 amu) + 10 (1.008 amu) + 4 (14.01 amu) + 2 (16.00 amu)
= 194.20 amu
Latihan Praktek Berapa massa molekul metanol (CH4O)?
Ada satu atom C, 4 atom H, satu atom O, jadi massa molekul CH4O adalah
1 (12.01 amu) + 4 (1.008 amu) + 1 (16.00 amu)
= 32,042 amu
Contoh 4.9
Jelaskan bagaimana Anda akan menyiapkan 5,00 × 10² mL larutan 1,75 M H2SO4, dimulai dengan larutan stok 8,61 M H2SO4.
Strategi Karena konsentrasi larutan akhir lebih kecil dari larutan asli, ini adalah proses pengenceran. Perlu diingat bahwa dalam pengenceran, konsentrasi larutan berkurang tetapi jumlah mol zat terlarut tetap sama.
Solusi Kami menyiapkan perhitungan dengan mentabulasi data:
Substitusikan ke persamaan (4.3),
Jadi, kita harus mengencerkan 102 mL larutan 8,61 M H2SO4, dengan air secukupnya untuk menghasilkan volume akhir 5,00 × 10² mL dalam labu ukur 500 mL untuk mendapatkan konsentrasi yang diinginkan.
Periksa Volume awal lebih kecil dari volume akhir, jadi jawabannya masuk akal.
Latihan Bagaimana cara mempersiapkan 2,00×10² mL larutan NaOH 0.866 M, dimulai dengan larutan stok 5,07 M?
Encerkan larutan NaOH untuk menurunkan konsentrasi dari 5,07 M menjadi 0,866 M. Karena jumlah mol zat terlarut tetap sama, kita dapat menyamakan jumlah mol zat terlarut sebelum dan sesudah pengenceran.
MiVi = MfVf
Dimana, Mi dan Mf merupakan konsentrasi larutan awal, konsentrasi larutan akhir
Vi dan Vf merupakan volume larutan awal, volume larutan akhir
Dengan menggunakan persamaan ini, kita dapat menyelesaikan volume awal dari larutan 5,07 M.
Jadi, untuk menyiapkan 200 mL larutan NaOH 0,866 M, kita perlu mengencerkan 34,2 mL larutan stok 5,07 M dengan air.
Contoh 5.1
Tekanan di luar pesawat jet yang terbang di ketinggian turun jauh di bawah standar tekanan atmosfir. Karena itu, udara di dalam kabin harus diberi tekanan untuk melindungi penumpang. Berapakah tekanan di atmosfer di dalam kabin jika diukur dengan barometer adalah 688 mmHg?
Strategi Karena 1 atm = 760 mmHg, faktor konversi berikut diperlukan untuk dapatkan tekanan di atmosfer:
Solusi Tekanan di dalam kabin diberikan oleh
Contoh 6.5
Sampel air berukuran 466 g dipanaskan dari 8,50°C hingga 74,60°C. Hitung jumlah panas yang diserap (dalam kilojoule) oleh air.
Strategi Kita mengetahui jumlah air dan kalor jenis air. Dengan informasi ini dan kenaikan suhu, kita dapat menghitung jumlah panas yang diserap (q).
Solusi Menggunakan Persamaan (6.12), kami menulis
Periksa Satuan g dan °C batal, dan kita tersisa dengan satuan yang diinginkan kJ. Karena panas diserap oleh air dari sekitarnya, ini bertanda positif.
Latihan Batang besi dengan massa 869 g mendingin dari 94°C hingga 5°C. Hitung panas yang dilepaskan (dalam kilojoule) oleh logam.



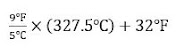











Comments
Post a Comment