BAB 23. Logam Transisi Kimia dan Koordinasi Senyawa
23.1 Sifat Logam Transisi Logam [kembali]
Transisi biasanya
memiliki subkulit d yang tidak terisi penuh atau mudah menimbulkan ion dengan
subkulit d yang tidak terisi penuh (Gambar 23.1). (Logam Golongan 2B-Zn, Cd, dan Hg-tidak
memiliki konfigurasi elektron yang khas dan oleh karena itu, meskipun
kadang-kadang disebut logam transisi, logam-logam ini sebenarnya tidak termasuk
dalam kategori ini.) Atribut ini bertanggung jawab atas beberapa sifat
penting, termasuk pewarnaan yang khas,
pembentukan senyawa paramagnetik, aktivitas katalitik, dan terutama
kecenderungan besar untuk membentuk ion kompleks. Dalam bab ini kami fokus pada elemen baris
pertama dari skandium hingga tembaga, logam transisi yang paling umum. Tabel 23.1 mencantumkan beberapa propertinya.
Saat
kita membaca setiap periode dari kiri ke kanan, nomor atom bertambah, elektron
ditambahkan ke kulit terluar, dan muatan inti bertambah oleh proton. Pada unsur-unsur periode ketiga-natrium
menjadi argon-elektron terluar dengan lemah melindungi satu sama lain dari
muatan inti ekstra. Akibatnya, jari-jari
atom berkurang dengan cepat dari natrium menjadi argon, dan elektronegativitas
serta energi ionisasi terus meningkat (lihat Gambar 8.5, 8.11, dan 9.5).
Untuk logam transisi, trennya berbeda. Melihat Tabel 23.1 kita melihat bahwa muatan inti, tentu saja, meningkat dari skandium menjadi tembaga, tetapi elektron ditambahkan ke subkulit 3d bagian dalam. Elektron 3d ini melindungi elektron 4s dari kenaikan muatan inti lebih efektif daripada elektron kulit terluar yang dapat melindungi satu sama lain, sehingga jari-jari atom mengurangi penambahan lebih sedikit dengan cepat. Untuk alasan yang sama, elektronegativitas dan energi ionisasi hanya meningkat sedikit dari skandium ke tembaga dibandingkan dengan peningkatan dari natrium menjadi argon.
Gambar
23.1
Logam transisi (kotak biru). Perhatikan bahwa meskipun elemen Grup 2B (Zn, Cd,
Hg) dijelaskan sebagai transisi logam oleh beberapa ahli kimia, baik logam
maupun ionnya tidak memiliki subkulit d yang tidak terisi penuh.
Meskipun logam transisi kurang elektropositif (atau lebih elektronegatif) dibandingkan logam alkali dan alkali tanah, potensi reduksi standar logam transisi baris pertama menunjukkan bahwa semua logam transisi kecuali tembaga harus bereaksi dengan asam kuat seperti asam klorida untuk menghasilkan hidrogen. gas. Namun, kebanyakan logam transisi tidak bereaksi terhadap asam atau bereaksi lambat dengan mereka karena adanya lapisan pelindung oksida. Contoh kasusnya adalah kromium: Meskipun memiliki potensi reduksi standar yang agak negatif, secara kimiawi ia cukup lembam karena pembentukan kromium (III) oksida, Cr2O3 pada permukaannya. Akibatnya, kromium sering digunakan sebagai pelapis pelindung dan non korosif pada logam lain. Pada bagian bawah dan trim mobil vintage, pelapisan kromium berfungsi sebagai tujuan dekoratif dan fungsional.
Sifat Fisik Umum
Sebagian besar logam transisi memiliki struktur padat (lihat Gambar 11.29) di mana setiap atom memiliki bilangan koordinasi 12. Selain itu, unsur-unsur ini memiliki jari-jari atom yang relatif kecil. Efek gabungan dari pengepakan terdekat dan ukuran atom kecil menghasilkan ikatan logam yang kuat. Oleh karena itu, logam transisi memiliki kepadatan yang lebih tinggi, titik leleh dan titik didih yang lebih tinggi, serta kalor fusi dan penguapan yang lebih tinggi daripada logam Golongan 1A, 2A, dan 2B (Tabel 23.2).
Konfigurasi Elektron
Konfigurasi elektron dari logam transisi baris pertama telah didiskusikan pada Bagian 7.9. Kalsium memiliki konfigurasi elektron [Ar] 4s². Dari skandium hingga tembaga, elektron ditambahkan ke orbital 3d. Jadi, konfigurasi elektron terluar skandium adalah 4s23d1, titanium adalah 4s23d2, dan seterusnya. Dua pengecualian adalah kromium dan tembaga, yang konfigurasi elektron terluarnya masing-masing adalah 4s13d5 dan 4s13d10 . Penyimpangan ini adalah hasil dari stabilitas ekstra yang terkait dengan subkulit 3d yang terisi setengah dan terisi penuh.
Ketika logam transisi baris pertama membentuk kation, elektron dikeluarkan terlebih dahulu dari orbital 4s dan kemudian dari orbital 3d. (Ini adalah kebalikan dari urutan pengisian orbital dalam atom.) Misalnya, konfigurasi elektron terluar Fe2+ adalah 3d6, bukan 4s23d4.
Keadaan Oksidasi
Logam transisi
menunjukkan bilangan oksidasi variabel dalam senyawanya. Gambar 23.2 menunjukkan bilangan oksidasi
dari skandium menjadi tembaga.
Perhatikan bahwa bilangan oksidasi yang umum untuk setiap unsur meliputi
+2, +3, atau keduanya. Bilangan oksidasi
+3 lebih stabil di awal deret, sedangkan di akhir bilangan oksidasi +2 lebih
stabil. Alasan untuk tren ini dapat
dipahami dengan memeriksa plot energi ionisasi pada Gambar 23.3. Secara umum, energi ionisasi meningkat secara
bertahap dari kiri ke kanan. Namun,
energi ionisasi ketiga (ketika sebuah elektron dilepaskan dari orbital 3d)
meningkat lebih cepat daripada energi ionisasi pertama dan kedua. Karena dibutuhkan lebih banyak energi untuk
melepaskan elektron ketiga dari logam yang berada di dekat ujung baris daripada
yang ada di dekat awal, logam yang berada di dekat ujung cenderung membentuk
ion M2+ daripada ion M3+.
Bilangan
oksidasi tertinggi untuk logam transisi adalah +7, untuk mangan (4s23d5). Untuk unsur-unsur di sebelah kanan Mn (Fe ke
Cu), bilangan oksidasi lebih rendah.
Logam transisi biasanya menunjukkan bilangan oksidasi tertinggi dalam
senyawa dengan unsur yang sangat negatif elektro seperti oksigen dan fluor —
misalnya, V2O5, CrO3, dan Mn2O7.
Gambar 23.3 Status oksidasi logam transisi baris
pertama. Bilangan oksidasi paling stabil
ditunjukkan dengan warna. Bilangan
oksidasi nol dijumpai pada beberapa senyawa, seperti Ni (CO), dan Fe (CO),
23.2 Kimia Besi dan Tembaga [kembali]
Gambar 23.4
menunjukkan logam transisi baris pertama.
Pada bagian ini, kita akan secara singkat mensurvei kimia dua unsur ini
- besi dan tembaga - dengan perhatian khusus pada keberadaan, pembuatan,
penggunaan, dan senyawa penting mereka.
Besi
Setelah aluminium,
besi adalah logam yang paling melimpah di kerak bumi (6,2 persen massa). Itu ditemukan di banyak bijih; beberapa yang penting adalah hematit, Fe2O3;
siderite, FeCO3; dan
magnetit, Fe3O4 (Gambar 23.5).
Persiapan
besi dalam tanur sembur dan pembuatan baja dibahas dalam Bagian 21.2. Besi murni adalah logam abu-abu dan tidak
terlalu keras. Ini adalah elemen penting
dalam sistem kehidupan.
Besi bereaksi dengan asam klorida menghasilkan gas hidrogen:
Fe (s) + 2H+ (aq) → Fe2+ (aq) + H2 (g)
 |
| gambar 23.4 logam transisi baris pertama |
 |
Gambar 23.5 Bijih besimagnetit, Fe3O4 |
Asam sulfat pekat
mengoksidasi logam menjadi Fe3+, tetapi asam nitrat pekat menjadikan
logam “ pasif "dengan membentuk
lapisan tipis Fe3O4 di atas permukaan. Salah satu reaksi
besi yang paling terkenal adalah pembentukan karat (lihat Bagian 18.7). Dua
bilangan oksidasi besi adalah +2 dan +3. Besi (II ) senyawa termasuk FeO (hitam), FeSO4
· 7H2O (hijau), FeCl2 (kuning), dan FeS (hitam).
Dengan adanya oksigen, ion Fe3+ dalam larutan dengan mudah
teroksidasi menjadi ion Fe³ +. Besi
(III) oksida berwarna coklat kemerahan, dan besi (III) klorida berwarna
hitam kecoklatan.
Tembaga
 |
Gambar 23.6 Kalkopirit, CuFeS2 |
Tembaga, unsur
langka (6,8 × 10-3 persen massa kerak bumi), ditemukan di alam dalam
keadaan tidak tergabung serta di bijih
seperti kalkopirit, CuFeS2 (Gambar 23.6). Logam coklat kemerahan
diperoleh dengan memanggang bijih untuk menghasilkan Cu2S dan
kemudian logam tembaga:
2CuFeS2 (s) + 4O2 (g) → Cu2S (s) + 2FeO (s) + 3SO2(g)
Cu2S (s) + O2 (g) → 2Cu (l) + SO2 (g)
Tembaga tidak murni dapat dimurnikan dengan elektrolisis (lihat Bagian 21.2). Setelah perak, yang terlalu mahal untuk penggunaan skala besar, tembaga memiliki konduktivitas listrik tertinggi. Itu juga merupakan konduktor termal yang baik. Tembaga digunakan dalam paduan, kabel listrik, pipa ledeng (pipa), dan koin.
Tembaga hanya bereaksi dengan asam sulfat pekat panas dan asam nitrat (lihat Gambar 22.7). Dua bilangan oksidasi pentingnya adalah +1 dan +2. Keadaan +1 kurang stabil dan tidak proporsional dalam larutan:
2Cu+ (aq)
→ Cu (s) + Cu2+ (aq)
Semua senyawa Cu
(I) diamagnetik dan tidak berwarna kecuali untuk Cu2O, yang berwarna
merah. Senyawa Cu (II) semuanya
paramagnetik dan berwarna. Ion Cu2+
terhidrasi berwarna biru. Beberapa
senyawa penting Cu (II) adalah CuO (hitam), CuSO4 · 5H2O
(biru), dan CuS (hitam).
23.3 Senyawa Koordinasi Logam [kembali]
Transisi memiliki
kecenderungan berbeda untuk membentuk ion kompleks (lihat hal. 756). Senyawa koordinasi biasanya
terdiri dari ion kompleks dan ion counter.
[Perhatikan bahwa beberapa senyawa koordinasi seperti Fe (CO)5
tidak mengandung ion kompleks.] Pemahaman kita tentang sifat senyawa koordinasi
berasal dari karya klasik Alfred Werner, 'yang membuat dan mengkarakterisasi
banyak senyawa koordinasi. Pada tahun
1893, pada usia 26 tahun, Werner mengajukan apa yang sekarang sering disebut
sebagai teori koordinasi Werner.
Ahli
kimia abad kesembilan belas dibuat bingung oleh kelompok reaksi tertentu yang
tampaknya melanggar teori valensi.
Misalnya, valensi unsur-unsur dalam kobalt (III) klorida dan amonia
tampaknya terpenuhi sepenuhnya, namun kedua zat ini bereaksi membentuk senyawa
stabil yang memiliki rumus CoCl3 · 6NH, - Untuk menjelaskan
perilaku ini, Werner mendalilkan bahwa
sebagian besar elemen menunjukkan dua jenis valensi: valensi primer dan valensi
sekunder. Dalam terminologi modern. valensi primer sesuai dengan bilangan
oksidasi dan valensi sekunder dengan bilangan koordinasi unsur. Dalam CoCl, · 6NH3. menurut
Werner, kobalt memiliki valensi primer 3 dan valensi sekunder 6.
Hari
ini kita menggunakan rumus [Co(NH3)6]Cl3 untuk
menunjukkan bahwa molekul amonia dan atom kobalt membentuk ion kompleks;
ion klorida bukan bagian dari kompleks tetapi terikat oleh gaya ionik. Sebagian besar, tetapi tidak semua, logam
dalam senyawa koordinasi adalah logam transisi.
Molekul atau ion yang mengelilingi logam dalam ion kompleks disebut ligan (Tabel 23.3). Interaksi antara atom logam dan ligan dapat dianggap sebagai reaksi asam basa Lewis. Seperti yang kita lihat di Bagian 15.12, basa Lewis adalah zat yang mampu mendonasikan satu atau lebih pasangan elektron. Setiap ligan memiliki setidaknya satu pasangan elektron valensi yang tidak digunakan bersama, seperti yang ditunjukkan contoh berikut:
Oleh karena itu, ligan
berperan sebagai basa Lewis. Sebaliknya,
atom logam transisi (baik dalam keadaan netral atau bermuatan positif)
bertindak sebagai asam Lewis, menerima (dan berbagi) pasangan elektron dari
basa Lewis. Jadi, ikatan logam-ligan
biasanya merupakan ikatan kovalen koordinat (lihat Bagian 9.9).
'Alfred
Werner (1866–1919). Ahli kimia
Swiss. Werner memulai sebagai seorang
ahli kimia organik tetapi menjadi tertarik pada kimia koordinasi. Untuk teori senyawa koordinasinya, Werner
dianugerahi Penghargaan Nobel Kimia pada tahun 1913.
Atom dalam ligan yang terikat langsung ke atom
logam dikenal sebagai atom donor.
Misalnya, nitrogen adalah ion kompleks.
Bilangan koordinasi dalam senyawa koordinasi didefinisikan
sebagai jumlah atom donor yang mengelilingi atom logam pusat dalam ion
kompleks. Misalnya, bilangan
koordinasi Ag+ di [Ag(NH3)2]+
adalah 2, Cu2+ di [Cu(NH3)4]2+
adalah 4, dan Fe3+ di [Fe(CN)6]3- adalah 6.
Atom paling umum dalam bilangan koordinasi adalah 4 dan 6, tetapi bilangan
koordinasi seperti 2 dan 5 juga dikenal.
Bergantung pada jumlah atom donor yang ada, ligan diklasifikasikan sebagai mono-dentate, bidentate, atau polydentate (lihat Tabel 23.3). H2O dan NH3 adalah ligan monodentat dengan masing-masing hanya satu atom donor. Salah satu ligan bidentat adalah ethylenediamine (kadang disingkat "en"):
Kedua
atom nitrogen dapat berkoordinasi dengan atom logam, seperti yang ditunjukkan
pada Gambar 23.7.
Gambar 23.7 (a) Struktur dari kation kompleks metal-ethylenediamine, seperti
[Co(en)3]2+. Setiap molekul ethylenediamine menyediakan
dua atom donor N dan oleh karena itu merupakan ligan bidentat. (b) Struktur
yang disederhanakan dari kation kompleks yang sama.
Ligan bidentat dan polidentat disebut juga agen pengkelat karena kemampuannya menahan atom logam seperti cakar (dari bahasa Yunani chele, yang berarti "cakar" ). Salah satu contohnya adalah ion ethylenediaminetetraacetate (EDTA), ligan polidentat yang digunakan untuk mengobati keracunan logam (Gambar 23.8). Enam atom donor memungkinkan EDTA membentuk ion kompleks yang sangat stabil dengan timbal. Dalam bentuk ini, dikeluarkan dari darah dan jaringan dan dikeluarkan dari tubuh. EDTA juga digunakan untuk membersihkan tumpahan logam radioaktif.
Bilangan Oksidasi Logam dalam Senyawa Koordinasi
Sifat penting
lainnya dari senyawa koordinasi adalah bilangan oksidasi atom logam pusat. Muatan bersih ion kompleks adalah jumlah muatan
pada atom logam pusat dan ligan di sekitarnya.
Dalam ion [PtCl6]2-, misalnya, setiap ion klorida
memiliki bilangan oksidasi - 1, jadi bilangan oksidasi Pt harus +4. Jika ligan tidak mengandung muatan bersih,
bilangan oksidasi logamnya adalah sama dengan muatan ion kompleks. Jadi, dalam [Cu(NH3)4]2+
setiap NH3 netral, jadi
bilangan oksidasi Cu adalah +2.
Gambar 23.8 (a)
kompleks EDTA timbal. Kompleks ini
memiliki muatan bersih 2– karena masing-masing dari enam atom donor O memiliki
muatan 1- dan ion timbal membawa muatan 2+.
Hanya pasangan mandiri yang berpartisipasi dalam ikatan yang
ditampilkan. Perhatikan geometri
oktahedral di sekitar ion Pb2+.
(b) Model molekuler dari kompleks Pb2+ -EDTA. Bola hijau adalah ion Pb2+.
Penamaan Senyawa Koordinat
Sekarang kita telah membahas berbagai jenis ligan dan bilangan oksidasi logam, langkah kita selanjutnya adalah mempelajari apa yang disebut senyawa koordinasi ini. Aturan penamaan senyawa koordinasi adalah sebagai berikut:
1. Kation dinamai sebelum anion, seperti pada senyawa ionik lainnya. Aturan tersebut berlaku terlepas dari apakah ion kompleks memiliki muatan positif atau negatif. Misalnya, dalam senyawa K3[Fe(CN)6] dan [Co(NH3)4Cl2]Cl, kita menamai kation K+ dan [Co(NH3)4Cl2]+ terlebih dahulu.
2. Dalam ion kompleks, ligan dinamai pertama, dalam urutan abjad, dan ion logam dinamai terakhir.
3. Nama-nama ligan anionik diakhiri dengan huruf o, sedangkan ligan netral biasa disebut dengan nama molekulnya. Pengecualiannya adalah H2O(aqua), CO (karbonil), dan NH3 (ammine). Tabel 23.4 mencantumkan beberapa ligan yang umum.
4. Jika ada beberapa ligan dari jenis tertentu, kita menggunakan prefiks Yunani di-, tri-, tetra-, penta-, dan hexa- untuk menamainya. Jadi, ligan dalam kation [Co(NH3)4Cl2]+ adalah "tetraamminedichloro." (Perhatikan bahwa prefiks diabaikan saat ligan alfabet.) Jika ligan itu sendiri mengandung prefiks Yunani, kita menggunakan prefiks bis (2) , tris (3), dan tetrakis (4) untuk menunjukkan jumlah ligan yang ada. Sebagai contoh, ligan etilenadiamina sudah mengandung di; oleh karena itu, jika ada dua ligan, namanya bis (ethylenediamine)
5. Bilangan oksidasi logam ditulis dalam angka romawi mengikuti nama logamnya. Sebagai contoh, angka romawi III digunakan untuk menunjukkan bilangan oksidasi +3 dari kromium dalam [Cr(NH3)4Cl2]+, yang disebut tetraammine- ion diklorokromium (III)
6. Jika kompleks
adalah anion, namanya berakhiran -at. Misalnya, dalam K4[Fe(CN)6]
anion [Fe(CN)6]4- disebut hexacyanoferrate (II) ion
Perhatikan bahwa angka Romawi II menunjukkan bilangan oksidasi besi Tabel 23.5
memberikan nama-nama anion yang mengandung atom logam.
23.4 Struktur Senyawa Koordinasi [kembali]
Dalam mempelajari
geometri senyawa koordinasi, kita sering menemukan bahwa terdapat lebih dari
satu cara untuk menyusun ligan di sekitar atom pusat. Senyawa yang disusun ulang dengan cara ini
memiliki sifat fisik dan kimia yang sangat berbeda. Gambar 23.9 menunjukkan empat susunan
geometris yang berbeda untuk atom logam dengan ligan monodentat. Dalam diagram ini, kita melihat bahwa
struktur dan bilangan koordinasi atom logam berhubungan satu sama lain sebagai
berikut:
Stereoisomer adalah senyawa
yang terdiri dari jenis dan jumlah atom yang sama yang terikat bersama dalam
urutan yang sama tetapi dengan pengaturan spasial yang berbeda. Ada dua jenis stereoisomer: isomer geometri
dan isomer optik. Senyawa koordinasi
mungkin menunjukkan satu atau kedua jenis isomerisme. Perhatikan, bagaimanapun, bahwa banyak senyawa
koordinasi tidak memiliki stereoisomer.
Isomer Geometrik
Isomer geometri
adalah stereoisomer yang tidak dapat diubah tanpa memutuskan ikatan kimia. Isomer geometris biasanya berpasangan. Kami menggunakan istilah "cis" dan "trans"
untuk membedakan satu isomer geometri suatu senyawa dari yang lain. Cis berarti
bahwa dua atom tertentu (atau kelompok atom) berdekatan satu sama lain, dan
trans berarti bahwa atom (atau kelompok atom)
atom) berada pada sisi yang berlawanan dalam rumus struktur. Isomer cis dan
trans dari senyawa koordinasi umumnya memiliki warna, titik leleh, momen dipol,
dan reaktivitas kimia yang cukup berbeda. Gambar 23.10 menunjukkan isomer cis
dan trans dari diamminedichloroplatinum
(II) Perhatikan bahwa meskipun jenis ikatan sama pada kedua isomer (dua
ikatan Pt-N dan dua ikatan Pt-Cl), pengaturan spasialnya berbeda. Contoh
lainnya adalah ion tetraamminedichloro-cobalt (III), yang ditunjukkan pada
Gambar 23.11
Isomer Optik
Isomer optik adalah bayangan
cermin nonsuperimposable. (“Superimposable” berarti bahwa jika satu struktur
diletakkan di atas yang lain, posisi semua atom akan cocok.) Seperti isomer
geometri, isomer optik datang berpasangan.
Namun, isomer optik dari
Gambar 23.10
Isomer (a) cis dan (b) trans diamminedichloroplatinum (I). Perhatikan bahwa dua atom CI berdekatan satu
sama lain dalam isomer cis dan saling berhadapan secara diagonal dalam isomer
trans.
 Gambar 23.11
Isomer (a) cis dan (b) trans dari ion tetraamminedichlorocobalt (III), [CO(NH3)4Cl2]+. Struktur yang ditunjukkan pada (c) dapat
dihasilkan dengan memutarnya pada (a), dan struktur yang ditunjukkan pada (d)
dapat dihasilkan dengan memutarnya pada (b).
Ion hanya memiliki dua isomer geometri, (a) [atau (c)] dan (b) [atau (d)].
Gambar 23.11
Isomer (a) cis dan (b) trans dari ion tetraamminedichlorocobalt (III), [CO(NH3)4Cl2]+. Struktur yang ditunjukkan pada (c) dapat
dihasilkan dengan memutarnya pada (a), dan struktur yang ditunjukkan pada (d)
dapat dihasilkan dengan memutarnya pada (b).
Ion hanya memiliki dua isomer geometri, (a) [atau (c)] dan (b) [atau (d)]. Senyawa memiliki
sifat fisika dan kimia yang identik, seperti titik leleh, titik didih, momen
dipol, dan reaktivitas kimiawi terhadap molekul yang bukan merupakan isomer
optik itu sendiri. Isomer optik berbeda
satu sama lain dalam interaksinya dengan cahaya terpolarisasi bidang, seperti
yang akan kita lihat.
Hubungan
struktural antara dua isomer optik analog dengan hubungan antara tangan kiri
dan kanan. Jika Anda meletakkan tangan
kiri Anda di depan cermin, gambar yang Anda lihat akan terlihat seperti tangan
kanan Anda (Gambar 23.12). Kami
mengatakan bahwa tangan kiri dan tangan kanan Anda adalah bayangan cermin satu
sama lain. Namun, keduanya tidak dapat
ditepis, karena ketika Anda meletakkan tangan kiri di atas tangan kanan (dengan
kedua telapak tangan menghadap ke bawah), keduanya tidak cocok.
Gambar
23.13 menunjukkan isomer cis dan trans dari dichlorobis (ethylenediamine) -
cobalt (III) ion dan gambarnya.
Pemeriksaan yang cermat mengungkapkan bahwa isomer trans dan bayangan
cerminnya adalah superimposable, tetapi isomer cis dan bayangan cerminnya
tidak. Oleh karena itu, isomer cis dan
bayangan cerminnya adalah isomer optik.
Isomer
optik dideskripsikan sebagai kiral (dari kata Yunani untuk
"tangan") karena, seperti tangan kiri dan kanan Anda, molekul kiral
tidak dapat ditempa. Isomer yang dapat ditumpuk dengan bayangan cerminnya
dikatakan akiral. Molekul kiral memainkan peran penting dalam reaksi enzim dalam sistem biologis.
Banyak molekul obat merupakan kiral. Menarik untuk dicatat bahwa seringkali
hanya satu dari sepasang isomer kiral yang efektif secara biologis.
Gambar 23.14 Pengoperasian polarimeter. Awalnya, tabung diisi dengan senyawa akiral. Penganalisis diputar sehingga bidang polarisasinya tegak lurus dengan bidang polarisasinya. Dalam kondisi ini, tidak ada cahaya yang mencapai pengamat. Selanjutnya, senyawa kiral ditempatkan di dalam tabung seperti yang ditunjukkan. Bidang polarisasi cahaya terpolarisasi diputar saat bergerak melalui tabung sehingga sebagian cahaya mencapai pengamat. Memutar penganalisis (baik ke kiri atau ke kanan) hingga tidak ada cahaya yang mencapai pengamat lagi memungkinkan sudut rotasi optik diukur.
23.5 Ikatan dalam Senyawa Koordinasi : Teori Medan Kristal
Teori Medan
Kristal Teori ikatan yang memuaskan dalam senyawa koordinasi harus
memperhitungkan sifat-sifat seperti warna dan magnet, serta stereokimia dan
kekuatan ikatan. Belum ada teori tunggal
yang melakukan semua ini untuk kita.
Sebaliknya, beberapa pendekatan berbeda telah diterapkan pada kompleks
logam transisi. Kita hanya akan membahas
salah satunya di sini - teori medan kristal - karena ia menjelaskan sifat warna
dan magnet dari banyak senyawa koordinasi.
Kita
akan memulai pembahasan kita tentang teori medan kristal dengan kasus yang
paling lugas, yaitu ion kompleks dengan geometri oktahedral. Kemudian kita akan melihat bagaimana ini
diterapkan pada kompleks tetrahedral dan bujur sangkar.
Percikan Fleld Kristal
Dalam Kompleks Oktahedral
Teori medan
kristal menjelaskan ikatan dalam ion kompleks murni dalam istilah gaya
listrik. Dalam ion kompleks, dua jenis
interaksi elektrostatis berperan. Salah
satunya adalah tarikan antara ion logam positif dan ligan bermuatan negatif
atau ujung ligan kutub yang bermuatan negatif.
Ini adalah gaya yang mengikat ligan ke logam. Jenis interaksi kedua adalah tolakan
elektrostatis antara pasangan elektron bebas pada ligan dan elektron di orbital
d logam.
Seperti
yang kita lihat di Bab 7, orbital d memiliki orientasi yang berbeda, tetapi
jika tidak ada gangguan eksternal, orbital-orbital d memiliki energi yang
sama. Dalam kompleks oktahedron, atom
logam pusat dikelilingi oleh enam pasang elektron bebas (pada enam ligan),
sehingga kelima orbital d mengalami tolakan elektrostatis. Besarnya tolakan ini bergantung pada
orientasi orbital d yang terlibat.
Ambil orbital dx² - y² sebagai contoh. Pada Gambar 23.16, kita melihat bahwa lobus
titik orbital ini mengarah ke sudut oktahedron sepanjang sumbu x dan y,
di mana pasangan elektron bebasnya telah diposisikan.
 Gambar
23.16 Kelima orbital d dalam lingkungan oktahedral. Atom logam (atau ion) berada di pusat
oktahedron, dan enam pasangan elektron bebas pada atom donor ligan berada di
sudut.
Gambar
23.16 Kelima orbital d dalam lingkungan oktahedral. Atom logam (atau ion) berada di pusat
oktahedron, dan enam pasangan elektron bebas pada atom donor ligan berada di
sudut. Gambar
23.17 Pembelahan medan kristal antara orbital d dalam kompleks oktahedral.
Jadi, elektron
yang berada di orbital ini akan mengalami tolakan yang lebih besar dari ligan
daripada elektron di, katakanlah, orbital dxy. Karena alasan ini, energi orbital dx²
- y² meningkat relatif terhadap orbital dxy, d̟yz,
dan dxz. Energi
orbital d2 juga lebih besar, karena lobusnya mengarah ke ligan sepanjang sumbu z.
Akibat
interaksi ligan logam ini, lima orbital d dalam kompleks oktahedral terbagi
menjadi dua set tingkat energi: tingkat yang lebih tinggi dengan dua orbital (dx²
- y² dan d z²) memiliki energi yang sama dan
tingkat yang lebih rendah dengan tiga orbital
orbital berenergi sama (dxy, dyz dan dxz),
seperti yang ditunjukkan pada Gambar 23.17.
Pembelahan medan kristal (∆) adalah perbedaan energi antara dua set
orbital d dalam atom logam jika terdapat ligan.
Besarnya ∆ tergantung pada logam dan sifat ligannya; ia memiliki efek langsung pada warna dan
sifat magnetis ion kompleks.
Warna
Dalam Bab 7 kita
mempelajari bahwa cahaya putih, seperti sinar matahari, adalah kombinasi dari
semua warna. Suatu zat tampak hitam jika
menyerap semua cahaya tampak yang menyentuhnya.
Jika tidak menyerap cahaya tampak, warnanya putih atau tidak
berwarna. Suatu objek tampak hijau jika menyerap
semua cahaya tetapi memantulkan komponen hijau.
Sebuah objek juga terlihat hijau jika memantulkan semua warna kecuali
merah, warna pelengkap hijau (Gambar 23.18).
Apa
yang dikatakan tentang cahaya yang dipantulkan juga berlaku untuk cahaya yang ditransmisikan
(yaitu, cahaya yang melewati media, misalnya, larutan). Pertimbangkan ion cupric terhidrasi, [Cu(H2O)6
]2+, yang menyerap cahaya di daerah spektrum oranye sehingga larutan
CuSO4 tampak biru bagi kita.
Ingatlah kembali dari Bab 7 bahwa ketika energi foton sama dengan
perbedaan antara keadaan dasar dan keadaan tereksitasi, absorpsi terjadi saat
foton mengenai atom (atau ion atau senyawa), dan elektron dipromosikan ke
tingkat yang lebih tinggi. Pengetahuan
ini memungkinkan kita menghitung perubahan energi yang terlibat dalam transisi
elektron. Energi foton, diberikan oleh
Persamaan (7.2), adalah
E = hv
di mana h
mewakili konstanta Planck (6.63 × 10-34 J • s) dan v adalah
frekuensi radiasi, yaitu 5.00 × 1014 / s untuk panjang gelombang 600 nm. Di sini E = ∆, jadi kita memiliki
∆
= hv
=
(6.63 × 10-34 J • s) (5.00 × 1014 / s)
=
3.32 × 10-19J
(Perhatikan bahwa
ini adalah energi yang diserap oleh satu ion.) If panjang gelombang foton yang diserap oleh
sebuah ion berada di luar wilayah tampak, kemudian cahaya yang ditransmisikan
terlihat sama (bagi kami) seperti cahaya yang datang — putih — dan ion tampak
tak berwarna.
Cara terbaik untuk
mengukur pemisahan medan kristal adalah dengan menggunakan spektroskopi untuk
menentukan panjang gelombang di mana cahaya diserap. Ion [Ti(H2O)6]3+
memberikan contoh langsung, karena Ti3+ hanya memiliki satu elektron
3d [Gambar 23.19 (a)]. Ion [Ti(H2O)6]3+
menyerap cahaya di wilayah spektrum yang terlihat (Gambar 23.20). Panjang gelombang yang sesuai dengan serapan
maksimum adalah 498 nm [Gambar 23.19 (b)].
Informasi ini memungkinkan kami untuk menghitung pemisahan medan kristal
sebagai berikut. Kita mulai dengan
menulis
∆ = hv (23.1)
Juga
di mana c adalah
kecepatan cahaya dan A adalah panjang gelombang. Oleh karena itu
adalah energi yang
dibutuhkan untuk merangsang satu ion [Ti(H2O)6]3+. Untuk menyatakan perbedaan energi ini dalam
satuan kilojoule per mol yang lebih sesuai, kita tulis
∆ = (3,99 × 101º J / ion) (6,02 × 10²³
ion / mol)
=
240.000 J / mol
=
240 kJ / mol
Dibantu oleh data
spektroskopi untuk sejumlah kompleks,
semua memiliki ion logam yang sama tetapi memiliki ligan yang berbeda, ahli
kimia menghitung pemisahan kristal untuk setiap ligan dan membuat deret
spektrokimia, yang merupakan daftar ligan yang disusun dalam urutan yang
meningkat dari kemampuannya untuk membagi tingkat energi orbital d:
I ¯ < Br ¯ <
CI ¯< OH ¯ < F ¯ <H2O <NH3 < en < CN ¯
< CO
Ligan-ligan ini
disusun dalam urutan kenaikan nilai ∆. CO dan CN ¯ disebut ligan medan-kuat,
karena mereka menyebabkan pemisahan
besar tingkat energi orbital d. Ion halida dan ion hidroksida adalah ligan
medan lemah, karena mereka memisahkan orbital d ke tingkat yang lebih rendah.
Sifat Magnetik
Besarnya pemisahan
medan kristal juga menentukan sifat magnet
sebuah ion kompleks. Ion [Ti(H2O)6]3+,
hanya memiliki satu elemen ctron, selalu
paramagnetic. Namun, untuk ion dengan
beberapa elektron d, situasinya kurang jelas.
Pertimbangkan, misalnya, kompleks oktahedral [FeF6]3¯
dan [Fe(CN)6]3¯ (Gambar 23.21). Konfigurasi elektron Fe3+ adalah
[Ar]3d5, dan ada dua cara yang mungkin untuk mendistribusikan
lima elektron d di antara orbital d.
Menurut aturan Hund (lihat Bagian 7.8), stabilitas maksimum dicapai
ketika elektron ditempatkan di lima orbital terpisah dengan spin paralel. Tetapi pengaturan ini hanya dapat dicapai
dengan biaya; dua dari lima elektron
harus dipromosikan ke orbital dx² - y² dan da yang
berenergi lebih tinggi. Tidak diperlukan
investasi energi seperti itu jika kelima elektron memasuki orbital dxy,
dyz dan dxz.
Menurut prinsip pengecualian Pauli (p. 305), hanya akan ada satu
elektron tak berpasangan yang hadir dalam kasus ini.
Gambar
23.22 menunjukkan distribusi elektron di antara orbital d yang menghasilkan
kompleks spin rendah dan tinggi. Susunan
elektron yang sebenarnya ditentukan oleh jumlah stabilitas yang diperoleh
dengan memiliki spin paralel maksimum versus investasi energi yang dibutuhkan
untuk mendorong elektron ke orbital d yang lebih tinggi. Karena F adalah ligan medan lemah, lima
elektron d memasuki lima orbital d terpisah dengan spin paralel untuk membuat
kompleks spin tinggi (lihat Gambar 23.21).
Di sisi lain, ion sianida adalah ligan medan kuat, jadi secara energetik
lebih disukai jika kelima elektron berada di orbital yang lebih rendah dan oleh
karena itu kompleks spin rendah terbentuk.
Kompleks
spin-tinggi jumlah sebenarnya dari elektron yang tidak berpasangan (atau spin)
dalam ion kompleks dapat ditemukan dengan pengukuran magnetik, dan secara umum,
temuan eksperimental mendukung prediksi
berdasarkan
pemisahan bidang kristal. Namun,
perbedaan antara kompleks spin rendah dan spin tinggi hanya dapat dibuat jika
ion logam mengandung lebih dari tiga dan kurang dari delapan elektron d,
seperti yang ditunjukkan pada Gambar 23.22.
Kompleks Tetrahedral dan
Bujur Sangkar
Sejauh ini kita
memiliki tingkat energi yang terkonsentrasi di dua jenis kompleks
lain-tetrahedral dan bujur sangkar-juga dapat diperhitungkan secara memuaskan
oleh teori medan kristal. Faktanya, pola
pemisahan ion tetrahedral adalah kebalikan dari pola pemisahan kompleks
oktahedral. Dalam hal ini, orbital dxy,
dyz dan dxz lebih dekat ke ligan dan oleh
karena itu memiliki lebih banyak energi daripada orbital dx²
- y² dan d z² (Gambar 23.23). Kebanyakan kompleks tetrahedral adalah
kompleks spin tinggi. Diduga, susunan
tetrahedral mengurangi besarnya interaksi logam-ligan, menghasilkan nilai ∆
yang lebih kecil dibandingkan dengan kasus oktahedral. Ini adalah asumsi yang masuk akal karena
jumlah ligan dalam kompleks tetrahedral lebih kecil.
Seperti
yang ditunjukkan Gambar 23.24, pola pemisahan untuk kompleks bujur sangkar
adalah yang paling rumit dari ketiga kasus.
Jelas, orbital dx² - y² memiliki energi
tertinggi (seperti dalam kasus oktahedral), dan orbital dy tertinggi
berikutnya. Akan tetapi, penempatan
relatif orbital d z² dan dxy dan dyz
tidak dapat ditentukan hanya dengan inspeksi dan harus dihitung.
Gambar 23.23 Bidang kristal pemisahan antara orbital d dalam sebuah kompleks tetrahedral.
Gambar
23.24 Diagram tingkat energi untuk kompleks bujur sangkar. Karena ada lebih dari dua tingkat energi,
kita tidak dapat mendefinisikan pemisahan medan kristal seperti yang kita bisa
untuk kompleks oktahedral dan tetrahedral.
23.6 Reaksi Senyawa Koordinasi [kembali]
Ion kompleks
mengalami reaksi pertukaran ligan (atau substitusi) dalam larutan. Laju reaksi ini sangat bervariasi, tergantung
pada sifat ion logam dan ligannya.
Dalam
mempelajari reaksi pertukaran ligan, seringkali berguna untuk membedakan antara
stabilitas ion kompleks dan kecenderungannya untuk bereaksi, yang kita sebut
labilitas kinetik. Stabilitas dalam
konteks ini adalah sifat termodinamika, yang diukur dalam istilah konstanta
pembentukan spesies Kf (lihat hal. 756). Sebagai contoh, kita katakan bahwa ion
kompleks tetrasionikelat (II) stabil karena memiliki konstanta formasi yang
besar (Kf = 1 × 1030)
Dengan menggunakan
ion sianida berlabel pada isotop
radioaktif karbon-14, ahli kimia telah menunjukkan bahwa [Ni(CN)4]2-
mengalami pertukaran ligan dengan sangat cepat dalam larutan. Keseimbangan
berikut ditetapkan segera setelah spesies bercampur:
di mana tanda
bintang menunjukkan atom 14C. Kompleks seperti ion tetrasionikelat
(II) disebut kompleks labil karena mereka menjalani reaksi pertukaran ligan
yang cepat. Jadi, secara termodinamika
spesies stabil (yaitu, spesies yang memiliki konstanta formasi besar)
tidak selalu tidak reaktif. (Dalam Bagian 13.4 kita melihat bahwa semakin kecil
energi aktivasi, semakin besar konstanta laju, dan karenanya semakin besar
laju.)
secara
termodinamika tidak stabil dalam larutan asam adalah [Co(NH3)6]3+.
Konstanta kesetimbangan untuk reaksi berikut adalah sekitar 1 × 1020:
Ketika
kesetimbangan tercapai, konsentrasi ion [Co(NH3)6]3+
sangat rendah. Namun, reaksi ini
membutuhkan beberapa hari untuk selesai karena kelembaman ion [Co(NH3)6]3+
. Ini adalah contoh kompleks inert, ion kompleks yang mengalami reaksi
pertukaran yang sangat lambat (dalam urutan jam atau bahkan hari). Ini menunjukkan bahwa spesies yang secara
termodinamika tidak stabil tidak selalu responsif secara kimiawi. Laju reaksi ditentukan oleh energi aktivasi,
yang tinggi dalam kasus ini.
Kebanyakan ion kompleks yang mengandung Co3+, Cr3+, dan Pt2+ bersifat inert secara kinetik. Karena mereka bertukar ligan sangat lambat, mereka mudah dipelajari dalam larutan. Akibatnya, pengetahuan kita tentang ikatan, struktur, dan isomerisme senyawa koordinasi sebagian besar berasal dari studi senyawa ini.
23.7 Aplikasi Senyawa Koordinasi [kembali]
Metalurgi
Ekstraksi perak dan emas dengan pembentukan kompleks sianida (hlm. 965) dan pemurnian nikel (hlm. 937) dengan mengubah logam menjadi senyawa gas Ni (CO), adalah contoh tipikal penggunaan senyawa koordinasi dalam proses metalurgi.
Agen Chelating Terapeutik
Sebelumnya telah disebutkan bahwa agen khelat EDTA digunakan dalam pengobatan keracunan timbal. Senyawa tertentu yang mengandung platina dapat secara efektif menghambat pertumbuhan sel kanker. Kasus khusus dibahas di hal. 1018.
Analisis Kimiawi
Meskipun EDTA
memiliki afinitas yang tinggi untuk sejumlah besar ion logam (terutama ion 2+
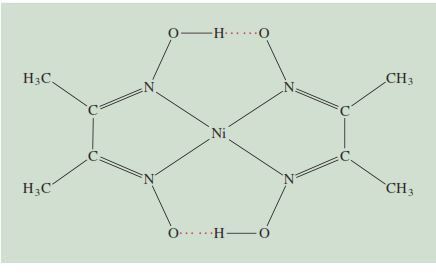
dan 3+), khelat lain lebih selektif dalam pengikatan. Misalnya, dimetilglioksim,
membentuk padatan
merah bata yang tidak larut dengan Ni2+ dan padatan kuning cerah
yang tidak larut dengan Pd2+.
Warna karakteristik ini digunakan dalam analisis kualitatif untuk
mengidentifikasi nikel dan paladium.
Selanjutnya, jumlah ion yang ada dapat ditentukan dengan analisis
gravimetri (lihat Bagian 4.6) sebagai berikut: Ke larutan yang mengandung ion
Ni2+, katakanlah, kita menambahkan reagen dimetilglioksim berlebih,
dan endapan berwarna merah bata. Endapan
kemudian disaring, dikeringkan, dan ditimbang.
Mengetahui rumus kompleks (Gambar 23.25), kita dapat dengan mudah
menghitung jumlah nikel yang ada dalam larutan aslinya.
































Comments
Post a Comment